Acetamido
Acetamido | ||
 | ||
Plata kemia strukturo de la Acetamido | ||
 | ||
Tridimensia kemia strukturo de la Acetamido | ||
Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | C2H5NO | |
| CAS-numero-kodo | 60-35-5 | |
| ChemSpider kodo | 173 | |
| PubChem-kodo | 178 | |
| Merck Index | 15,44 | |
Fizikaj proprecoj | ||
| Aspekto | senkolora higroskopa solidaĵo | |
| Molmaso | 59.068 g·mol-1 | |
| Denseco | 1.159g cm−3 | |
| Fandpunkto | 79 °C | |
| Bolpunkto | 221.2 °C | |
| Refrakta indico | n76120{displaystyle n_{761}^{20}} 1,4274 | |
| Ekflama temperaturo | 126 °C | |
| Memsparka temperaturo | 560 °C | |
| Acideco (pKa) | 16.5 | |
| Solvebleco | Akvo:2000 g/L | |
| Mortiga dozo (LD50) | 7000 mg/kg (buŝe) | |
Sekurecaj Indikoj | ||
| Riskoj | R40 | |
| Sekureco | S2 S36/37 | |
Pridanĝeraj indikoj | ||
Danĝero
| ||
GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H351[1] | |
| GHS Deklaroj pri antaŭgardoj | P201, P202, P281, P308+313, P405, P501 | |
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo (25 °C kaj 100 kPa) | ||
Acetamido aŭ etanamido estas plej simpla amido derivata el la acetata acido, senkolora higroskopa solidaĵo kun mucida odoro. Ĝi estas neakordigebla kun fortaj acidoj, fortaj oksidigaj agentoj kaj fortaj bazoj. Acetamido estas ĉefe uzata kiel solvanto, plastiganto, humidiga kaj penetriga agento.
Acetamido estas milde irita al homa haŭto dum longedaŭra ekspozicio. Laboratoriaj eksperimentoj elmontras ke akuta ingestado povas kaŭzi moderan toksecon. Ripeta ingestado povas kaŭzi hepato-tumorojn. Ĝi estas antaŭaĵo de la tioacetamido.
Enhavo
1 Sintezoj
1.1 Sintezo 1
1.2 Sintezo 2
1.3 Sintezo 3
2 Reakcio
2.1 Reakcio 1
2.2 Reakcio 2
3 Literaturo
4 Vidu ankaŭ
5 Referencoj
Sintezoj |
Sintezo 1 |
- Acetamido estas preparata per senhidratigo de la amonia acetato:
 →−H2O{displaystyle {underset {}{xrightarrow {-;H_{2}O}}}} →−H2O{displaystyle {underset {}{xrightarrow {-;H_{2}O}}}} |
Sintezo 2 |
- Acetamido ankaŭ sintezeblas per hidratigo de la acetonitrilo:
 |
Sintezo 3 |
Acetamido ankaŭ prepareblas per interagado de la acetila klorido kaj amoniako:
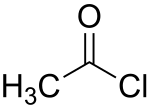 →+NH3{displaystyle {underset {}{xrightarrow {+;NH_{3}}}}} →+NH3{displaystyle {underset {}{xrightarrow {+;NH_{3}}}}} |
Reakcio |
Reakcio 1 |
- Pro la amfotera karaktero de la acetamido, ĝi reakcias kun fortaj neorganikaj acidoj por estigi malstabilajn salojn, tian kian la acetamido-hidrokloridon:
 →+HCl{displaystyle {underset {}{xrightarrow {+;HCl}}}} →+HCl{displaystyle {underset {}{xrightarrow {+;HCl}}}} .HCl .HCl |
Reakcio 2 |
Acetamido ankaŭ reakcias kun kalia hidroksido estigante acetamido-kalion kaj akvon:
 →+KOH→CH3CONHKkaliaacetamido+H2O{displaystyle {underset {}{xrightarrow {+;KOH}}}{mathsf {rightarrow {underset {kalia;acetamido}{CH_{3}CONHK}}+H_{2}O}}} →+KOH→CH3CONHKkaliaacetamido+H2O{displaystyle {underset {}{xrightarrow {+;KOH}}}{mathsf {rightarrow {underset {kalia;acetamido}{CH_{3}CONHK}}+H_{2}O}}} |
Literaturo |
- Organic Syntheses
- Chemical Book
Small Animal Toxicology, Michael Edward Peterson, Patricia A. Talcott
Hazardous Chemicals: Safety Management and Global Regulations, T.S.S. Dikshith
Progress in Botany: Genetics Physiology Systematics Ecology, Karl Esser,Ulrich Lüttge,Wolfram Beyschlag,Jin Murata
Handbook of Chemicals and Safety, T.S.S. Dikshith
Vidu ankaŭ |
- Acetoacetamido
- Tioacetamido
- Acetamidino
- Amonia acetato
- Amonia klorido
- Acetilcisteino
- Fenil-acetamido
- Kloro-acetamido
- Fluoro-acetamido
- Ciano-acetamido
Referencoj |
↑ Pubchem







