Monoklonaler Antikörper
Monoklonale Antikörper sind Antikörper, also immunologisch aktive Proteine, die von einer Zelllinie (Zellklon) produziert werden, die auf einen einzigen B-Lymphozyten zurückgehen, und die sich gegen ein einzelnes Epitop richten. Eine physiologisch (natürlich) vorkommende Immunantwort gegen ein in den Körper eingedrungenes Antigen ist dagegen stets polyklonal und richtet sich z. B. gegen viele verschiedene Epitope auf einem Bakterium.
In der Diagnostik und Forschung spielen monoklonale Antikörper eine große Rolle, da sie mit hoher Spezifität eine Anzahl von Molekülen binden können. Die Bindung der Antikörper lässt sich dann mit unterschiedlichen Techniken nachweisen. Diese Antigen-Antikörper-Reaktion bildet die Grundlage für zahlreiche experimentelle und diagnostische Verfahren (z. B. Immunphänotypisierung, FACS, Immunhistologie, ELISA, ELISPOT, Radioimmunassay und Western Blot).
Viele der von monoklonalen Antikörpern erkannten Zelloberflächenantigene menschlicher Zellen werden in der CD-Nomenklatur klassifiziert.
Inhaltsverzeichnis
1 Herstellung monoklonaler Antikörper
2 Therapeutische monoklonale Antikörper
3 Terminologie der monoklonalen Antikörper
4 Listen entwickelter Antikörper
4.1 Zugelassene oder in klinischer Erprobung (Phase III) befindliche therapeutische monoklonale Antikörper
4.2 Zur In-vivo-Diagnostik zugelassene monoklonale Antikörper
4.3 Zurückgezogene oder aufgegebene diagnostische monoklonale Antikörper
4.4 In präklinischer Prüfung oder Phase I/II-Studien befindliche therapeutische monoklonale Antikörper
4.5 Zurückgezogene oder aufgegebene therapeutische monoklonale Antikörper
5 Einzelnachweise
Herstellung monoklonaler Antikörper |

Herstellung monoklonaler Antikörper durch Hybridom-Technik
Das Prinzip der Herstellung monoklonaler Antikörper wurde 1975 von César Milstein, Georges Köhler und Niels Jerne publiziert,[1] die dafür im Jahr 1984 den Nobelpreis für Medizin erhielten.[2] Die Technik beruht auf der Verschmelzung von Antikörper-produzierenden B-Zellen mit Zellen einer Myelom-Zelllinie, wodurch hybride Zellen entstehen, die unbegrenzt Antikörper einer bestimmten Spezifität produzieren (Hybridom-Technik).
Bei der Herstellung monoklonaler Antikörper gegen ein bestimmtes Antigen wird zunächst eine Maus mit diesem Antigen infiziert (1, siehe Abbildung). Aufgrund der Immunantwort kommt es zur Bildung von B-Lymphozyten, die Antikörper bilden, welche mit dem Antigen reagieren und die sich in der Milz anreichern. Aus der entnommenen Milz (2) werden die B-Lymphozyten isoliert und mit Zellen (Plasmazellen) einer aus einem Myelom (Plasmozytom) gewonnenen Zelllinie (3) fusioniert (4), es entstehen sogenannte Hybridomzelllinien (5). Diese Hybridomzellen vereinigen Eigenschaften ihrer Ursprungszellen: vom B-Lymphozyt die Eigenschaft einen bestimmten Antikörper zu produzieren, von der Myelomzelle die Fähigkeit zu unbegrenztem Wachstum im Reagenzglas. Für die Gewinnung des monoklonalen Antikörpers wird die Hybridomzelllinie ausgewählt, die am besten das gewünschte Epitop auf dem Antigen bindet (6). Die unsterbliche Zelllinie wird aufbewahrt und der Zellüberstand wird regelmäßig bei Bedarf geerntet. Die Produktion der monoklonalen Antikörper kann in vitro (7a), oder in vivo (7b) erfolgen. Die Antikörper (8) heißen monoklonal, weil sie aus einer einzigen Ursprungs-B-Zelle stammen und daher alle identisch sind.
Die Hybridzellen werden durch ein sogenanntes HAT-Medium selektiert. In diesem Nährmedium sind Hypoxanthin (ein natürlich vorkommendes Purinderivat), Thymidin und Aminopterin (Zellgift, das die Biosynthese von Purin- und Pyrimidinbasen hemmt) enthalten. Die B-Lymphozyten und damit auch die Hybridzellen können Hypoxanthin und Thymidin verstoffwechseln und so die Blockade, die durch das Aminopterin verursacht wird, umgehen. Die verwendeten Myelomzellen sind bezüglich des alternativen Stoffwechselweges Mangelmutanten und sterben im HAT-Medium ab.
Die nicht fusionierten B-Lymphozyten haben nur eine begrenzte Lebenszeit, sodass sich nach einigen Passagen nur noch die Hybridzellen in der Kultur finden lassen.
Einen großen Fortschritt insbesondere zur Klonierung humaner Antikörper bildet die Technik des Phagen-Display.
Therapeutische monoklonale Antikörper |

Derivate monoklonaler Antikörper
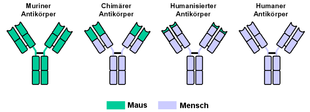
Modifizierte Antikörper für die therapeutische Anwendung
Die Versuche, monoklonale Antikörper in der Therapie einzusetzen, waren zunächst nicht sehr erfolgreich. Die verwendeten Antikörper der Maus (murine Antikörper, Endung: -omab) wirken im menschlichen Organismus selbst als Antigen und können eine gegen sie gerichtete Immunantwort auslösen. Auch die für ihre erwünschte Wirkung wichtige Interaktion mit Zellen des Immunsystems des Empfängers war aufgrund der unterschiedlichen Spezies nicht optimal.
Wesentliche Fortschritte wurden erst gemacht, nachdem es in den letzten Jahren gelungen ist, modifizierte, den menschlichen Antikörpern besser angepasste monoklonale Antikörper zu entwickeln.
Daneben werden auch Antikörperkonjugate, wie beispielsweise Immunzytokine, für therapeutische und diagnostische Anwendungen, speziell in der Krebsimmuntherapie, eingesetzt.
Terminologie der monoklonalen Antikörper |
Die Freihandelsnamen aller therapeutischer monoklonaler Antikörper tragen das Suffix „…mab“, was für „monoclonal antibody“ steht.
Nach Ähnlichkeit zu den menschlichen Antikörpern unterscheidet man (in aufsteigender Reihenfolge):
- murine Antikörper (von der Maus): Endung -omab
- Antikörper vom Primaten: Endung -imab
- chimäre Antikörper: Endung -ximab (Nur der variable Teil des AK ist Mausprotein.)
- humanisierte Antikörper: Endung -zumab (Nur die Antigenbindungstellen sind Mausprotein)
- vollhumane, rekombinante Antikörper: Endung -umab
Listen entwickelter Antikörper |
Zugelassene oder in klinischer Erprobung (Phase III) befindliche therapeutische monoklonale Antikörper |
| Name | Handelsname | Typ | Zielstruktur | Anwendungsgebiet |
|---|---|---|---|---|
Hämatologie, Onkologie | ||||
Alemtuzumab5 | MabCampath | humanisiert | CD52-Antigen auf Lymphozyten | Chronische lymphatische Leukämie, T-Zell-Lymphome2, akute lymphatische Leukämie2 |
Apolizumab1,2 | Remitogen | humanisiert | HLA-DR-Antigen auf B-Lymphozyten | Solide Tumoren, akute lymphatische Leukämie, chronische lymphatische Leukämie, Non-Hodgkin-Lymphome |
Atezolizumab (MPDL3280A)1,2 | Tecentriq (Roche) | humanisiert | PD-L1 | Blasenkrebs (zugelassen in USA)[3] In EU positive CHMP Empfehlung.[4] |
Avelumab (MSB0010718C)2 | Bavencio (Merck / Pfizer) | human | PD-L1 | Blasenkrebs, Nichtkleinzelliges Bronchialkarzinom (NSCLC)[5], Merkelzellkarzinom[6] |
Bevacizumab | Avastin (Roche) | humanisiert | VEGF (Vascular Endothelial Growth Factor) | Darmkrebs, Brustkrebs, nichtkleinzelliges Bronchialkarzinom, feuchte, altersbedingte Makuladegeneration (Off-Label-Use)2 |
Blinatumomab | Blincyto (Amgen) | murin, bispezifisch | CD-19 | ALL |
Catumaxomab | Removab (Neovii Biotech) | murin (Ratte/Maus), trifunktional | EpCAM-Antigen auf Tumorzellen, CD3-Rezeptor auf T-Lymphozyten | maligner Aszites aufgrund von EpCAM-positiven Karzinomen |
Cemiplimab1,2 (REGN2810) | N.N., (Sanofi / Regeneron) | vom Primaten | PD-1 | Plattenepithelkarzinom[7] |
Cetuximab | Erbitux (BMS / Merck) | chimär | EGF-Rezeptor (Epidermal Growth Factor Receptor) | Darmkrebs, Kopf- und Halstumoren |
Daratumumab1,2 | Darzalex (Genmab / Janssen Biotech) | human | CD38 | Multiples Myelom, in den USA und der EU bereits zugelassen[8][9] |
Durvalumab1,2 | Imfinzi (AstraZeneca / Medimmune) | human | PD-L1 | Bronchialkarzinom1,2 |
Eculizumab | Soliris (Alexion) | humanisiert | C5 Komplement-Faktor | Paroxysmale nächtliche Hämoglobinurie (PNH) |
Elotuzumab1,2 | Empliciti (BMS) | humanisiert | Signaling Lymphocyte Activation Molecule (SLAMF7; CS1) | Multiples Myelom, in den USA bereits zugelassen[10] |
Emicizumab1,2 (ACE910) | Hemlibra (Roche) | humanisiert, bispezifisch | Faktor IXa und X | Hemmkörperhämophilie[11] |
Epratuzumab1,2 | LymphoCide (UCB) | humanisiert | CD22-Antigen | Non-Hodgkin-Lymphome, Autoimmunerkrankungen, akute lymphatische Leukämie |
Gemtuzumab-Ozogamicin1 | Mylotarg (Wyeth) | humanisiert, Calicheamicin- beladen | CD33-Antigen | Akute myeloische Leukämie |
Ibritumomab-Tiuxetan | Zevalin (Bayer) | murin, 90Y-markiert | CD20-Antigen auf B-Lymphozyten | Non-Hodgkin-Lymphome (Radioimmuntherapie) |
Inotuzumab Ozogamicin (als Konjugat)1,2 | N.N. (Pfizer) | humanisiert | CD22-Antigen | Akute lymphatische Leukämie |
Ipilimumab | Yervoy (BMS) | human | CTLA-4 | Malignes Melanom |
Mogamulizumab | Poteligeo (Kyowa Hakko Kirin) | humanisiert | CCR4 | Adulte T-Zell-Leukämie, verschiedene Non-Hodgkin-Lymphome |
Moxetumomab pasudotox-tdfk1,2 | Lumoxiti (AstraZeneca) | murin | CD22-Antigen | Haarzellleukämie[12] |
Necitumumab1,2 | Portrazza (Eli Lilly) | human | EGF-Rezeptor (Epidermal Growth Factor Receptor) | Bronchialkarzinom, Magenkarzinom, in den USA bereits in NSCLC zugelassen[13] |
Nivolumab | BMS) | human | PD-1 | In Europa zugelassen bei Malignes Melanom und Nichtkleinzelliges Bronchialkarzinom[14] |
Obinutuzumab | Gazyva | humanisiert | CD20-Antigen auf B-Lymphozyten | Chronische lymphatische Leukämie, follikuläres Lymphom |
Ofatumumab | Arzerra (GSK) | human | CD20-Antigen auf B-Lymphozyten | Chronische lymphatische Leukämie |
Olaratumab1,2 | N.N. (Eli Lilly) | human | IgG1 auf PDGF Receptor-α (platelet-derived growth factor receptor α) | Sarkom |
Oregovomab1,2 | OvaRex (United Therapeutics) | murin | CA-125 | Ovarialkarzinom |
Panitumumab | Vectibix (Amgen) | human | EGF-Rezeptor (Epidermal Growth Factor Receptor) | EGF-Rezeptor exprimierende Tumoren, insb. metastasiertes kolorektales Karzinom |
Pembrolizumab (MK-3475) | Keytruda (MSD) | humanisiert | PD-1 | Melanom, Mesotheliom, NSCLC |
Pertuzumab | Perjeta (Roche) | humanisiert | HER2/neu, HER2/neu-Rezeptor; Pertuzumab inhibiert die Dimerisierung der Zielstruktur sowie deren Heterodimerisierung mit anderen HER-Rezeptoren (z. B. Epidermal Growth Factor Receptor (EGFR)), wodurch das Tumorwachstum verlangsamt werden soll | Mammakarzinom, klinische Studien u. a. beim Ovarialkarzinom, Bronchialkarzinom und Prostatakarzinom |
Ramucirumab | Cyramza (Eli Lilly) | human | VEGF Rezeptor 2 | Bronchialkarzinom, Magenkarzinom |
Rituximab | MabThera (Roche / Biogen) | chimär | CD20-Antigen auf B-Lymphozyten | Non-Hodgkin-Lymphome |
Rovalpituzumab tesirine1,2 | N.N. (Stemcentrx) | humanisiert | delta-like protein 3 (DLL3) | Kleinzelliges Bronchialkarzinom (SCLC) |
Siltuximab | Sylvant (Janssen) | chimär | bindet humanes IL-6 | Morbus Castleman (MCD), Multiples Myelom |
Tremelimumab1,2 | N.N. (AstraZeneca / Medimmune) | human | CTLA-4 | Bronchialkarzinom1,2Mesotheliom1,2 |
Tositumomab1 | Bexxar (GSK) | murin, 131I-markiert | CD20-Antigen auf B-Lymphozyten | Non-Hodgkin-Lymphome (Radioimmuntherapie) |
Trastuzumab | Herceptin (Roche) | humanisiert | HER2/neu-Rezeptor | Brustkrebs, Magenkarzinom |
Zanolimumab1,2 | HuMax-CD4 (Genmab) | human | CD4-Antigen auf T-Lymphozyten | T-Zell-Lymphome |
Autoimmunerkrankungen, Transplantatabstoßung, Schmerz | ||||
Adalimumab | Humira | human | TNF-α (Tumor Necrosis Factor α) | Rheumatoide Arthritis, Psoriasis-Arthritis, Morbus Bechterew, Morbus Crohn |
Alemtuzumab5 | Lemtrada | humanisiert | CD52-Antigen auf Lymphozyten | Multiple Sklerose |
Anifrolumab1,2 (MEDI-546) | N.N. | human | anti-type-I IFN | Lupus erythematodes |
Basiliximab | Simulect | chimär | CD25-Antigen (Interleukin-2-Rezeptor) | Prophylaxe der akuten Abstoßungsreaktion bei Nierentransplantation |
Belimumab | Benlysta | human | BLys (B-Lymphozyten-Stimulator, ein Zytokin der TNF-Superfamilie) | Lupus erythematodes |
Brodalumab1,2 | Kyntheum (LEO Pharma) | human | Interleukin-17-Rezeptor | Psoriasis, Psoriasis-Arthritis, Asthma |
Canakinumab | Ilaris | human | Interleukin-1-beta-Rezeptor | Periodische Fiebersyndrome (CAPS, TRAPS, HIDS/MKD, FMF), Systemische juvenile idiopathische Arthritis (SJIA), Gichtarthritis |
Certolizumab | Cimzia | humanisiert | TNF-α (Tumor Necrosis Factor α) | Rheumatoide Arthritis, Morbus Crohn |
Clazakizumab1,2 | N.N. (BMS) | humanisiert | Interleukin-6-Rezeptor | Rheumatoide Arthritis |
Daclizumab | Zenapax (a.H.); Zinbryta (a.H.) | humanisiert | CD25-Antigen (Interleukin-2-Rezeptor) | Multiple Sklerose, aber aus dem Handel (a.H.) genommen[15] |
Epratuzumab1,2 | LymphoCide | humanisiert | CD22-Antigen | Autoimmunerkrankungen, Non-Hodgkin-Lymphome, |
Fasinumab1,2 | N.N. (Regeneron) | human | Nerve Growth Factor (NGF) | Schmerz bei Osteoarthritis |
Guselkumab1,2 | Tremfya (Janssen) | human | Anti-Interleukin-23 | Psoriasis, Rheumatoide Arthritis |
Golimumab | Simponi | human | TNF-α (Tumor Necrosis Factor α) | Colitis ulcerosa, Rheumatoide Arthritis, Psoriasis-Arthritis, Morbus Bechterew |
Infliximab | Remicade | chimär | TNF-α (Tumor Necrosis Factor α) | Morbus Crohn, Rheumatoide Arthritis, Morbus Bechterew, Psoriasis-Arthritis, Colitis ulcerosa |
Ixekizumab | Taltz | humanisiert | Interleukin-17A-Rezeptor (IL-17A) | Psoriasis, Psoriasis-Arthritis |
Mavrilimumab (CAM-3001)1,2 | N.N. (AstraZeneca) | human | Rheumatoide Arthritis | |
Muromonab-CD3 | Orthoclon OKT3 | murin | CD3-Rezeptor auf T-Lymphozyten | Behandlung der akuten Abstoßungsreaktion bei Nieren-, Herz- und Lebertransplantationen |
Natalizumab3 | Tysabri | humanisiert | CD49d (α4-Integrin) | Multiple Sklerose |
Risankizumab1,2 | Skyrizi (AbbVie) | humanisiert | Interleukin-23-Rezeptor | Psoriasis[16], Psoriasis-Arthritis, Morbus Crohn |
Rituximab | MabThera | chimär | CD20-Antigen auf B-Lymphozyten | Rheumatoide Arthritis |
Sarilumab | Kevzara | human | Interleukin-6 Rezeptor (IL-6R) | Rheumatoide Arthritis |
Secukinumab | Cosentyx (Novartis) | human | Interleukin-17A-Rezeptor | Psoriasis, Psoriasis-Arthritis, Morbus Bechterew |
Sifalimumab (MEDI-545)1,2 | N.N. (AstraZeneca) | human | Lupus erythematodes | |
Sirukumab1,2 | Plivensia (Janssen Pharmaceutica / GlaxoSmithKline) | human | Interleukin 6-Rezeptor | Rheumatoide Arthritis, aber seitens der FDA negative Empfehlung[17] |
Tocilizumab | RoActemra | humanisiert | Interleukin 6-Rezeptor | Rheumatoide Arthritis, Zytokinsturm nach Behandlung mit CART-Zellen, Riesenzellarteriitis[18] |
Ustekinumab | Stelara | human | Interleukin 12/23 | Plaque-Psoriasis |
Vedolizumab1,2 | Entyvio | humanisiert | IgG1 | Morbus Crohn und Colitis ulcerosa |
Hypercholesterinämie | ||||
Alirocumab | Praluent (Sanofi) | human | PCSK9 (darüber indirekt: LDL Rezeptor) | Hypercholesterinämie (Prävention kardiovaskulärer Ereignisse einschl. Schlaganfall) |
Evinacumab (REGN1500)1,2 | NN (Regeneron / Sanofi) | human | PCSK9 | Homozygote familiäre Hypercholesterinämie |
Evolocumab (AMG-145) | Repatha (Amgen) | human | PCSK9 (darüber indirekt: LDL Rezeptor) | Hypercholesterinämie (Prävention kardiovaskulärer Ereignisse einschl. Schlaganfall) |
| Kardiovaskuläre Erkrankungen | ||||
Abciximab | ReoPro | chimär, Fab-Fragment | GPIIb/IIIa auf Thrombozyten | Verhinderung eines Gefäßverschlusses nach PTCA |
| Spezielle Therapieformen | ||||
Idarucizumab | Praxbind | humanisiert | Antikörperfragment (Fab), das mit sehr hoher Affinität an Dabigatran bindet. | Antidot zur raschen und spezifischen Aufhebung der durch Dabigatran bedingten Gerinnungshemmung[19] |
| Infektionskrankheiten | ||||
Bezlotoxumab1,2 | Zinplava (MSD) | human | Clostridium difficile Toxin B | Clostridium difficile-Infektion (CDI)[20] |
| Motavizumab4[21][22] | Numax | chimär | Bestandteil des Respiratory Syncytial Virus (RSV) | Prophylaxe der RSV (respiratory syncytial virus)-Pneumonie bei Frühgeborenen, ELBW (Extrem Low Birth Weight Preterm) und VLBW (Very Low Birth Weight Preterm) |
Palivizumab | Synagis | humanisiert | Bestandteil des Respiratory Syncytial Virus (RSV) | Prophylaxe der RSV-Pneumonie bei Frühgeborenen |
Ibalizumab-uiyk | Trogarzo | humanisiert | CD4-T-Zellrezeptor | AIDS |
| Neurologische Erkrankungen | ||||
Aducanumab1,2 | N.N. (Biogen) | human | tbd. | Alzheimer |
Eptinezumab | N.N. | humanisiert | Calcitonin Gene-Related Peptide (CGRP) | Migräne[23][24] |
Erenumab | Aimovig (Amgen) | human | Calcitonin Gene-Related Peptide (CGRP) receptor | Migräne[25][26][27] |
Fremanezumab1,2 | N.N. (Teva) | humanisiert | Calcitonin Gene-Related Peptide (CGRP) | Migräne[28] Cluster-Kopfschmerz[29] |
Galcanezumab1,2 | Emgality (Eli Lilly) | humanisiert | Calcitonin Gene-Related Peptide (CGRP) | Migräne[30][31] Cluster-Kopfschmerz[32] |
Ocrelizumab1,2 | Ocrevus (Roche) | humanisiert | CD20-Antigen | Multiple Sklerose |
Solanezumab1,2 | N.N. (Eli Lilly) | humanisiert | tbd. | Alzheimer-Krankheit |
Ublituximab | N.N. (TG Therapeutics) | chimär (mouse/ human) | CD20-Antigen auf B-Lymphozyten | Multiple Sklerose |
Augenheilkunde | ||||
Ranibizumab | Lucentis | humanisiert, Fab-Fragment | VEGF-A (Vascular Endothelial Growth Factor A) | Feuchte Makuladegeneration |
Dermatologie | ||||
Adalimumab | Humira | human | TNF-α (Tumor Necrosis Factor α) | Psoriasis |
Dupilumab | Dupixent (Sanofi) | human | Interleukin 4/13 | Atopisches Ekzem[33][34][35][36]Sinusitis |
Efalizumab | Raptiva | humanisiert | CD11a-Antigen | Psoriasis |
Infliximab | Remicade | chimär | TNF-α (Tumor Necrosis Factor α) | Psoriasis |
Nemolizumab1,2 | N.N. (Chugai) | humanisiert | Interleukin 31 | Atopisches Ekzem |
Ustekinumab | Stelara | human | Interleukin 12/23 | Plaque-Psoriasis |
Allergische Erkrankungen | ||||
Benralizumab | Fasenra (AstraZeneca) | humanisiert | Alpha-Untereinheit des IL-5-Rezeptors (IL-5Rα) | Asthma; in COPD bisher zwar geprüft, aber nicht erfolgreich[37] |
Mepolizumab | Nucala (GSK) | humanisiert | Interleukin-5 | Asthma, COPD, Hypereosinophilie-Syndrom, Eosinophile Granulomatose mit Polyangiitis |
Omalizumab | Xolair | humanisiert | IgE (Fc-Teil) | Schweres Asthma bronchiale, chronische idiopathische Urtikaria (Nesselsucht) |
Reslizumab | Cinqaero (Teva) | humanisiert | Interleukin-5 | Asthma |
Tralokinumab1,2 | N.N. (AstraZeneca / Medimmune) | humanisiert | IL-13 | Schweres Asthma bronchiale, Atopisches Ekzem |
Zahnheilkunde | ||||
| (plantibody)1,2 | CaroRx | rekombinant in Pflanzen hergestellt („plantibody“) | spezifische Bindung an Streptococcus mutans (Leitkeim der Zahnkaries) | als Mundspülung gegen Zahnkaries; Beseitigung von S. mutans aus der Mundflora[38] |
Osteologie | ||||
Denosumab | Prolia, XGEVA | human | RANK Ligand (Rezeptoraktivator des NF-κB Liganden, RANKL) | Osteoporose; Knochenmetastasen |
Romosozumab1,2 (AMG 785 / CDP7851) | N.N. (Amgen / UCB) | human | Sclerostin | postmenopausale Osteoporose |
1in Deutschland bisher nicht zugelassen (evt. nicht mehr aktuell!)
2in klinischer Prüfung
3Trotz möglicher seltener schwerer Nebenwirkungen von der FDA unter strengen Voraussetzungen wieder in den USA zugelassen, europäische Zulassung seit 6/2006
4Entwicklung eingestellt.
5Durch den Hersteller – als MabCampath – vom Markt genommen, um die Substanz unter einem neuen Handelsnamen und einer anderen Indikation (MS) wieder auf den Markt zu bringen.[39] Kritisiert von der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).[40]
Zur In-vivo-Diagnostik zugelassene monoklonale Antikörper |
| Name | Präparat | Typ | Zielstruktur | Anwendungsgebiet |
|---|---|---|---|---|
Sulesomab | LeukoScan® | murin, 99mTc-markiert | IMMU-MN3 Fab'-SH Fragment gegen Granulozyten | Osteomyelitis |
Arcitumomab | CEA-Scan® | murin, 99mTc-markiert | IMMU-4 F(ab')2 gegen CEA | kolorektales Karzinom |
Zurückgezogene oder aufgegebene diagnostische monoklonale Antikörper |
| Name | Präparat | Typ | Zielstruktur | Geplante Anwendungsgebiete | Komplikationen und Kommentar |
|---|---|---|---|---|---|
| Igovomab | Indimacis 125 | murin, 111In markiert | CA 125-Antigen | ovarielle seröse Adenokarzinome | 1999 auf Antrag der Herstellerfirma vom europäischen Markt genommen.[41] Begründung? |
In präklinischer Prüfung oder Phase I/II-Studien befindliche therapeutische monoklonale Antikörper |
| Name | Präparat | Typ | Zielstruktur | Anwendungsgebiet |
|---|---|---|---|---|
Atrosab | – | humanisiert | CD120a (TNFR1) | Morbus Crohn, Multiple Sklerose, Rheumatoide Arthritis |
Brentuximab | – | chimär | CD30 | Lymphome |
Cantuzumab | – | humanisiert, Mersantin-konjugiert | CanAg (MUC1), Antikörper konjugiert mit Mersantin (Toxin) | Darmkrebs, Magenkarzinom, Pankreaskarzinom, NSCLC |
Labetuzumab | – | humanisiert | Carcinoembryonales Antigen (CEA) | Darmkrebs, Pankreaskarzinom, Ovarialkarzinom |
Nimotuzumab | TheraCim® | humanisiert | EGF-Rezeptor (Epidermal Growth Factor Receptor) | metastasierendes Irinotecan-refraktäres Kolorektalkarzinom |
Mapatumumab | – | human | – | Darmkrebs |
Matuzumab | EMD72000 | humanisiert | EGF-Rezeptor (Epidermal Growth Factor Receptor) | Magenkrebs, Darmkrebs, NSCLC |
Pertuzumab | Omnitarg® | humanisiert | HER2/neu | Brustkrebs, Prostatakarzinom, Ovarialkarzinom, NSCLC |
R1450[42] | – | human | Amyloid-β | Alzheimer-Krankheit |
1D09C3[43] | – | human | MHC-II | Non-Hodgkin-Lymphom (NHL) |
Zurückgezogene oder aufgegebene therapeutische monoklonale Antikörper |
| Name | Präparat | Typ | Zielstruktur | Geplante Anwendungsgebiete | Komplikationen und Kommentar |
|---|---|---|---|---|---|
Bococizumab | N.N. (Pfizer) | humanisiert | PCSK9 (darüber indirekt: LDL Rezeptor) | Hypercholesterinämie | Pfizer hat die weitere Entwicklung eingestellt.[44] |
Briakinumab | – | p40-Untereinheit von Interleukin-12 (IL-12) und Interleukin-23 (IL-23) | Psoriasis | Zulassungsantrag von Abbott zurückgezogen | |
| Galiximab | – | chimär | CD80-Antigen | Non-Hodgkin-Lymphome | |
| Lumiliximab | – | chimär (Macaque/human) | CD23-Antigen auf B-Lymphozyten | Chronische lymphatische Leukämie | |
| Nebacumab | Centoxin® | humanisiert (IgM) | Endotoxin | Sepsis | Zulassung in Europa 1991, 1993 wegen erhöhter Sterblichkeit bei Patienten nach Behandlung mit Nebacumab im Vergleich zu Placebo vom Markt genommen.[45] |
| Edrecolomab | Panorex® | Maus IgG2a | EpCAM | Darmkrebs | Zulassung in Deutschland 1995, 2000 vom Markt genommen, da die bisherige Standardtherapie wirksamer war. |
TGN1412 | – | humanisiert | CD28 | Leukämie und Autoimmunerkrankungen (wie Multiple Sklerose und Rheuma) | Zytokinsturm. In der öffentlichen Kritik standen Mängel in der Versuchsplanung und -durchführung, z. B. dass das Präparat an 6 Probanden gleichzeitig abgegeben wurde, und dass die Wirkmechanismen nicht verstanden worden waren. |
Einzelnachweise |
↑ G. Köhler, C. Milstein: Continuous cultures of fused cells secreting antibody of predefined specificity. In: Nature. Bd. 256, 1975, S. 495–497. PMID 1172191. doi:10.1038/256495a0, Nachdruck in: J. Immunol. Bd. 174, S. 2453–2455. PMID 15728446, jimmunol.org (PDF)
↑ Informationen der Nobelstiftung zur Preisverleihung 1984 an César Milstein, Georges Köhler und Niels Jerne (englisch)
↑ Tess Stynes: FDA Approves Roche Immunotherapy for Bladder Cancer. In: wsj.com. 18. Mai 2016, abgerufen am 30. Mai 2016 (englisch).
↑ CHMP recommends EU approval for Roche’s TECENTRIQ (atezolizumab) in a specific type of metastatic lung and two types of metastatic bladder cancer, PM Roche vom 21. Juli 2017, abgerufen am 10. August 2017
↑ Klinische Studie (Phase 3): Avelumab in Non-Small Cell Lung Cancer (JAVELIN Lung 200) bei Clinicaltrials.gov der NIH
↑ Positive Stellungnahme des CHMP der EMA für Avelumab bei metastasiertem Merkelzellkarzinom, PM Merck vom 21. Juli 2017, abgerufen am 28. Juli 2017
↑ Sanofi and Regeneron Announce That Cemiplimab (REGN2810) Has Received FDA Breakthrough Therapy Designation for Advanced Cutaneous Squamous Cell Carcinoma, PM SanofiGenzyme vom 8. September 2017, abgerufen am 10. September 2017
↑ FDA approves Darzalex for patients with previously treated multiple myeloma, PM FDA vom 16. November 2015, abgerufen am 20. November 2015
↑ Janssen’s Single-Agent DARZALEX® (daratumumab) Approved by European Commission for Treatment of Multiple Myeloma (MM) | Business Wire. In: www.businesswire.com. Abgerufen am 23. Mai 2016.
↑ FDA approves Empliciti, a new immune-stimulating therapy to treat multiple myeloma, PM FDA vom 30. November 2015, abgerufen am 1. Dezember 2015
↑ Roche’s emicizumab for haemophilia A meets primary endpoint in phase III study, PM Roche vom 22. Dezember 2016, abgerufen am 5. Januar 2017
↑ US FDA approves Lumoxiti (moxetumomab pasudotox-tdfk) for certain patients with relapsed or refractory hairy cell leukaemia, PM AstraZeneca vom 14. September 2018, abgerufen am 14. September 2018
↑ FDA approves Portrazza to treat advanced squamous non-small cell lung cancer, PM FDA vom 24. November 2015, abgerufen am 25. November 2015
↑ PZ: Pharmazeutische Zeitung online: Nivolumab nun auch gegen Lungenkrebs. In: pharmazeutische-zeitung.de. 21. Juli 2015, abgerufen am 16. Mai 2016.
↑ Biogen und AbbVie geben die eigenverantwortliche weltweite Rücknahme der Marktzulassung von Zinbryta (Daclizumab) zur Behandlung der Multiplen Sklerose bekannt, PM Biogen vom 2. März 2018, abgerufen am 15. März 2018
↑ Positive Opinion, PM EMA vom 28. Februar 2019, abgerufen am 15. März 2019
↑ FDA ADVISORY COMMITTEE DOES NOT RECOMMEND APPROVAL OF SIRUKUMAB FOR THE TREATMENT OF MODERATELY TO SEVERELY ACTIVE RHEUMATOID ARTHRITIS, PM JNJ vom 2. August 2017, abgerufen am 14. August 2017
↑ Roche gains positive CHMP opinion for Actemra / RoActemra in giant cell arteritis, PM Roche vom 21. Juli 2017, abgerufen am 10. August 2017
↑ ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, EMA, abgerufen am 23. Mai 2017
↑ FDA Approves Merck’s ZINPLAVA™ (bezlotoxumab) to Reduce Recurrence of Clostridium difficile Infection (CDI) in Adult Patients Receiving Antibacterial Drug Treatment for CDI Who Are at High Risk of CDI Recurrence, PM Merck vom 21. Oktober 2016, abgerufen am 5. Januar 2017
↑ AstraZeneca discontinues development of motavizumab for RSV prophylaxis indication. AstraZeneca beendet die Entwicklung von Motavizumab in RSV, Pressemeldung von AstraZeneca vom 21. Dezember 2010
↑ Motavizumab in der englischsprachigen Wikipedia
↑ Ärzte Zeitung: Internationaler Kopfschmerz-Kongress: Neue Antikörper-Therapien gegen Migräne in Sicht. Abgerufen am 9. März 2018.
↑ David W Dodick, Peter J Goadsby, Stephen D Silberstein, Richard B Lipton, Jes Olesen, Messoud Ashina, Kerri Wilks, David Kudrow, Robin Kroll, Bruce Kohrman, Robert Bargar, Joe Hirman, Jeff Smith: Safety and efficacy of eptinizumab, an antibody to calcitonin gene-related peptide, for the prevention of frequent episodic migraine: A randomised, double-blind, placebo-controlled, exploratory phase 2 trial. In: The Lancet Neurology. 13, Nr. 11, 2014, S. 1100. doi:10.1016/S1474-4422(14)70209-1. PMID 25297013.
↑ FDA Accepts Biologics License Application For Aimovig™ (erenumab), PM Amgen vom 20. Juli 2017, abgerufen am 26. Juli 2017
↑ FDA Approves Aimovig™ (erenumab-aooe), A Novel Treatment Developed Specifically For Migraine Prevention,PM Amgen vom 17. Mai 2018, abgerufen am 19. Mai 2018
↑ Aimovig Multimedia News Release, abgerufen am 19. Mai 2018
↑ Ärzte Zeitung: Internationaler Kopfschmerz-Kongress: Neue Antikörper-Therapien gegen Migräne in Sicht. Abgerufen am 9. März 2018.
↑ A Study to Evaluate the Efficacy and Safety of TEV-48125 (Fremanezumab) for the Prevention of Episodic Cluster Headache (ECH). ClinicalTrials.gov Identifier: NCT02945046.
↑ Ärzte Zeitung: Internationaler Kopfschmerz-Kongress: Neue Antikörper-Therapien gegen Migräne in Sicht. Abgerufen am 9. März 2018.
↑ Emgality - Opinion, EMA vom 20. September 2018, abgerufen am 27. September 2018
↑ A Study of LY2951742 in Participants With Episodic Cluster Headache. ClinicalTrials.gov Identifier: NCT02397473
↑ Article in The New England Journal of Medicine vom 1. Oktober 2016 Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis
↑ Philipp Kressirer: Neuer Wirkstoff gegen Neurodermitis. In: IDW Informationsdienst Wissenschaft. idw-online.de, 5. Oktober 2016, abgerufen am 11. Oktober 2016.
↑ rme/aerzteblatt.de: Atopische Dermatitis: Dupilumab glänzt in Phase 3-Studien. In: Deutsches Ärzteblatt. Quelle: Clinical Trials (Studien SOLO 1 und SOLO 2), 4. Oktober 2016, abgerufen am 17. Oktober 2016.
↑ Zusammenfassung des EPAR für die Öffentlichkeit, EMA, abgerufen am 27. Oktober 2017
↑ GALATHEA Phase III trial did not meet the primary endpoint of a statistically-significant reduction of exacerbations in patients with COPD, PM AstraZeneca vom 11. Mai 2018, abgerufen am 20. Mai 2018
↑ CaroRx. planetbiotechnology.com
↑ Marktrücknahme von MabCampath® (PDF; 114 kB) Informationsschreiben von Genzyme, einem Unternehmen der Sanofi-Gruppe vom 10. August 2012.
↑ Information und Stellungnahme der AkdÄ zur Marktrücknahme von MabCampath® (Alemtuzumab) Newsletter der AkdÄ vom 24. August 2012.
↑ Community list of not active medicinal products for human use, abgerufen am 5. August 2007.
↑ Clinical Trials: R1450. Roche
↑ Monoklonaler Krebsantikörper 1D09C3 erhält von Europäischer Kommission Orphan-Drug-Status für chronische lymphatische Leukämie.
↑ Pfizer Discontinues Global Development of Bococizumab, Its Investigational PCSK9 Inhibitor, PM Pfizer vom 1. November 2016, abgerufen am 5. Januar 2017
↑ Artikel zu Nebacumab. In: New York Times
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |